JOURNAL ONKOLOGIE 10/2021
Seite 2/4
Histopathogenese und Klassifikation
GBM stammen von neuroglialen Vorläuferzellen ab und sind gekennzeichnet durch eine ausgeprägte histomorphologische und molekulare Heterogenität (12). Zu den histopathologischen Kerncharakteristika des GBM gehören das hochinfiltrative Wachstum, Kern- und Zellpleomorphie, ausgeprägte mikrovaskuläre Proliferation sowie intratumorale Nekrosen.Seit 2016 basiert die integrierte Diagnose eines GBM auf histopathologischen und mokulargenetischen Kriterien (13). Die diagnoserelevanten molekularen Marker können routinemäßig an Formalin-fixiertem Gewebe mit gängigen diagnostischen Techniken wie Immunhistochemie, FISH (Fluoreszenz-In-Situ-Hybridisierung) und zunehmend verbreiteter auch per DNA-Sequenzierung bestimmt werden. Vielen der molekularen Faktoren ist gemeinsam, dass sie eine Re-Programmierung des Transkriptoms sowie des Epigenoms bedingen und damit den Tumormetabolismus verändern. Zu dem frühesten mutagenen Ereignis in der Gliomentwicklung gehören Mutationen der Isocitratdehydrogenase (IDH), die mit einer günstigeren Prognose vergesellschaftet sind. GBM sind immer durch einen IDH-Wildtyp charakterisiert und können so von den Astrozytomen (welche immer IDH-mutiert sind) oder Oligodendrogliomen (welche immer IDH-mutiert, 1p19q-kodeletiert sind) unterschieden werden (14). Alterationen im EGFR-Gen (meist Amplifikationen) finden sich bei etwa 50% der primären GBM. Zudem werden chromosomale Aberrationen mit einem Zugewinn auf Chromosom 7 in Kombination mit einem Verlust auf Chromosom 10 (+7/-10) und TERT-Mutation beobachtet (4).
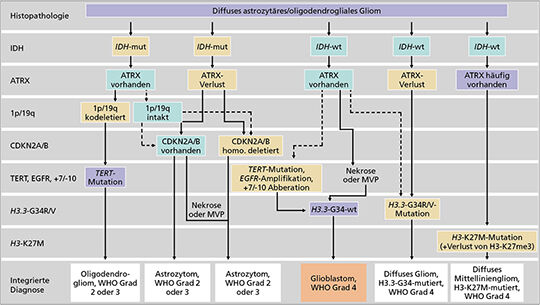
In der WHO-Klassifikation 2021 wird nun die Diagnose eines GBM auch unabhängig von der histopathologischen Begutachtung eingeführt (14). Die Kombination eines IDH-Wildtyps mit einer weiteren qualifizierenden Mutation (TERT-Promotor-Mutation, +7/-10 oder EGFR-Amplifikation) reicht für die Diagnosestellung eines GBM WHO Grad 4. Nach der neuen Nomenklatur werden die Differenzierungsgrade in arabischen Ziffern angegeben (4). IDH-mutierte Tumoren hingegen werden auch bei vorhandenen histologischen Merkmalen eines GBMs nun als Astrozytom WHO Grad 4 klassifiziert, unter anderem, um der günstigeren Prognose gerecht zu werden. Die Marker für die diagnostische Kategorisierung von Gliomen bei Erwachsenen sind in Abbildung 3 zusammengestellt.
Bei zweifelhaften Fällen (z.B. IDH-Wildtyp ohne weitere GBM-typische molekulare Marker) kann der Heidelberger Methylation Profiling Classifier für die Präzisierung der Diagnose hilfreich sein (15). Hierbei erfolgt ein Vergleich des Tumors mit Methylierungsmustern, die für etwa 100 verschiedene Hirntumortypen erstellt wurden. Auf Basis der eingegebenen Fälle wird die Präzision des Classifiers durch maschinelles Lernen stetig verbessert und erzielt in etwa jedem 10. Fall eine Revision der ursprünglichen (histologischen) Verdachtsdiagnose. Zusätzlich erlaubt dieser Ansatz auch die Identifizierung neuer Methylierungsgruppen, was bereits in der Einführung neuer Tumorentitäten resultierte (16). Während der Heidelberger Methylation Profiling Classifier wertvolle prognostische Informationen liefern kann, bleiben die therapeutischen Konsequenzen dieser Einteilungen bislang unklar.
Der bisher einzige etablierte molekulare Marker mit direkten therapeutischen Implikationen für das GBM ist der Methylierungsstatus des MGMT-Promotors. MGMT ist ein physiologisches Reparaturenzym, das die DNA am zellulären 6-O-Methylguanin repariert, in dem es Methylgruppen entfernt. Entsprechend sind Tumorzellen mit MGMT-Promotor-Methylierung (und damit wenig MGMT-Expression) deutlich empfindlicher auf alkylierende Substanzen. Etwa 30-40% der IDH-Wildtyp-GBM weisen eine MGMT-Promotor-Methylierung auf. Der Methylierungsstatus des MGMT-Promotors ist ein prädiktiver Faktor für das Ansprechen auf eine alkylierende Chemotherapie. Das Vorliegen einer Promotor-Methylierung ist mit einem etwa 50% längerem medianen Gesamtüberleben (mOS) assoziiert (17). Zwischen dem Ausmaß der Methylierung des MGMT-Promotors und dem Überleben unter Chemotherapie herrscht eine lineare Beziehung, und die quantitative Bestimmung des Ausmaßes der MGMT-Promotor-Methylierung erlaubt die Identifikation von Patient:innen mit einer sehr guten Prognose (18). Die MGMT-Promotor-Methylierung scheint im Tumor relativ homogen ausgeprägt und ist über den Verlauf der Erkrankung stabil (19). Die MGMT-Testung ist in verschiedenen Laboratorien zurzeit noch nicht einheitlich, eine Harmonisierung wird angestrebt.
Zwischenfazit
• Die neuropathologische Diagnose eines GBM beruht auf histopathologischen und molekularen Markern.• Auch in Abwesenheit typischer histopathologischer Merkmale kann die Diagnose eines GBM allein auf Basis einer charakteristischen molekularen Signatur gestellt werden.
• Die Methylierung des MGMT-Promotors ist mit einer deutlich günstigeren Prognose und einem besseren Ansprechen auf alkylierende Chemotherapie assoziiert.
Sie können folgenden Inhalt einem Kollegen empfehlen:
"Diagnostik und Therapie des Glioblastoms: Molekulare Diagnosekriterien, Therapiekonzepte und innovative Behandlungsansätze"
Bitte tragen Sie auch die Absenderdaten vollständig ein, damit Sie der Empfänger erkennen kann.
Die mit (*) gekennzeichneten Angaben müssen eingetragen werden!