Anzeige:

Medizin
News
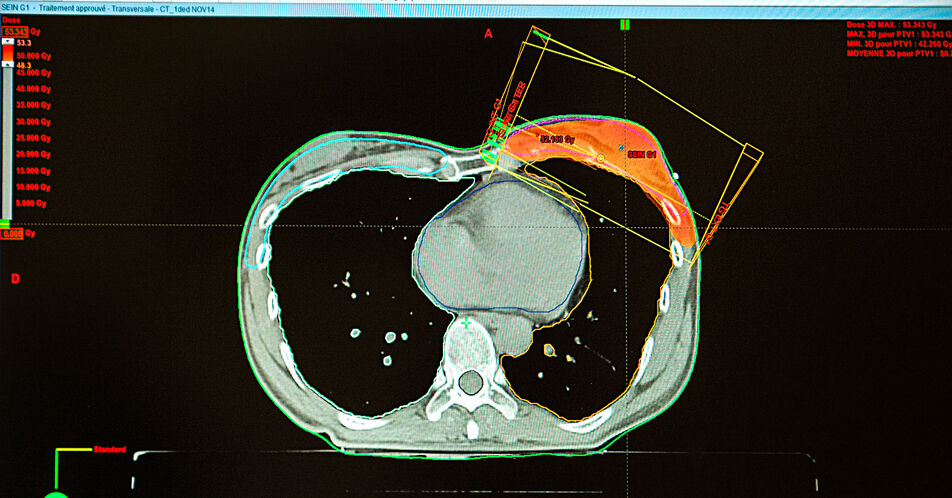
25.04.2024
News
25.04.2024
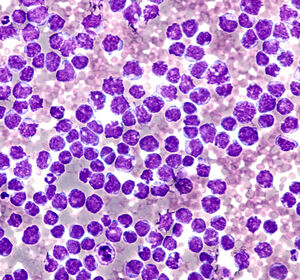
News
24.04.2024
Anzeige:

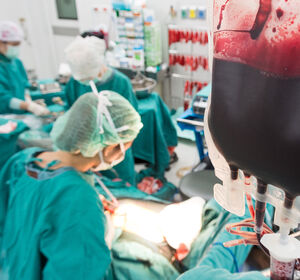
News
24.04.2024
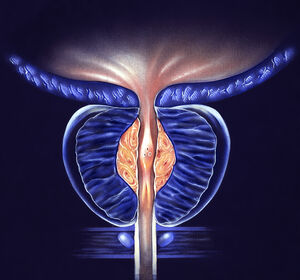
News
24.04.2024
News
24.04.2024
News
24.04.2024
News
23.04.2024
News
22.04.2024
News
21.04.2024
News
20.04.2024
News
19.04.2024
News
18.04.2024
News
18.04.2024
News
18.04.2024
News
18.04.2024
News
18.04.2024
News
18.04.2024
News
17.04.2024
News
17.04.2024